KALOR
Ketika pertengahan abad ke 18 orang masih menyamakan pengertian suhu dan kalor. Pada tahun 1760, Joseph Black mengemukakan bahwa suhu dan kalor memiliki perbedaan. Suhu di artikan sesuatu yang di ukur dengan termometer, sedangkan kalor diartikan fluida dari benda panas menuju benda dingin alam rangka mencapai keseimbangan termal. Pada tahun 1798 ilmuan Amerika Benjamin Thompson meragukan defini kalor sebagai fluida kalorik. Berdasarkan pengamatannya Thompson menyimpulkan bahwa kalor bukanlah fluida melainkan usaha yang dilakukan oleh kerja mekanis. Dalam persamaan matematika kalor dapat di tuliskan dalam persamaan berikut;
Satuan dari kalor dalam SI adalah Joule. Satuan lain dari kalor adalah kalori. Kalori dan joule apabila di konversikan perhitungannya seperti berikut.
1 kalori = 4,2 joule
1 joule = 0,24
1 kilo kalori = 4.200 joule
Satu kalori di definisikan sebagai banyaknya kalor yang diperlukan untuk menaikan suhu 1 gram air sebagai 1oC. Sementara itu, kalor jenis atau zat adalah banyaknya kalor yang diperlukan oleh suatu zat untuk menaikan suhu 1 kg zat sebesar 1oC.
KAPASITAS KALOR
Banyaknya kalor yang diperlukan untuk menaikkan suhu yang sama dari benda berbeda pada umumnya nilainya tidak sama. Perbandingan banyaknya kalor yang diberikkan terhadap kenaikkan suhu benda dinamakan kapasitas kalor. Kapasitas kalor suatu benda didefinisikan sebagai kemampuan suatu benda untuk menerima atau melepas kalor ketika menaikkan dan menurunkan suhu benda sebesar 1oC atau 1K . jika kalor yang dibutuhkan sebesar Q untuk menaikkan suhu benda sebesar T, maka kapasitas kalor benda dapat dituliskan dalam persamaan berikut:
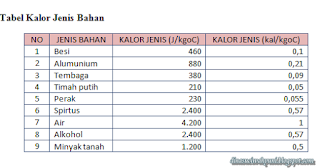
Tabel kalor jenis bahan
Kalor Lebur dan Kalor Uap
Kalor dapat menyebabkan benda mengalami perubahan wujud. Perubahan wujudnya dapat berupa ketika benda melebur atau benda menguap. Ketika benda melebur, benda memiliki kalor lebur. Sementara itu, ketika kalor menguap, benda memiliki kalor uap benda.
Persamaan matematis kalor lebur sebagai berikut:
Persamaan matematis kalor uap sebagai berikut:
Keterangan
Q = kalor ( kalori ) atau ( Joule)
m = massa es ( gram ) atau ( kg)
L = kalor lebur es ( kalori/gram) atau ( Joule/Kg)
U = kalor uap air ( kalori/gram) atau ( Joule/Kg)
GRAFIK KENAIKAN SUHU TERHADAP KALOR
AB = es mengalami kenaikkan suhu
BC = es melebur menjadi air
CD = air mengalami kenaikkan suhu
DE = air menuap menjadi uap air
ASAS BLACK
Apaila dua benda yang suhunya berbeda dicampurkan maka benda yang memiliki suhu tinggi akan memberikan kalor kpada benda yang suhunya rendah. Setelah terjadi percampuran , suhu kedua benda menjadi sama. Berdasarkan penjelasan tersebut, diperoleh hukum kekekalan energi yang menyatakan;
“ kalor yang dilepas oleh benda bersuhu tinggi akan sama besarnya dengan kalor yang diterima benda lain bersuhu rendah”
Apabila dituliskan dalam sebuah persamaan sebagai berikut:
Hukum kekelan energi pada pertukaran kalor yang ditunjukkan melalui persamaan di atas, pertama kali diukur oleh Joseph Black sehingga lebih dikenal sebagai Asas Black.
PERPINDAHAN KALOR
Konduksi
“perpindahan kalor yang tidak disertai oleh perpindahan partikel zat”
Contoh : perambatan panas besi yang dipanaskan ujungnya, maka ujung kain juga akan ikut panas.
Konveksi
“perpindahan kalor yang diikuti oleh perpindahan partikel zat”
Contoh : aliran udara di daerah pantai yang menyebabkan adanya angin darat dan angin laut.
Radiasi
“ perpindahan kalor yang dalam perambatannya tidak membutuhkan medium perambatan “
Contoh: panas pancaran sinar matahari ke permukaan bumi












0 Komentar